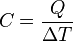RECUERDEN QUE ESTA ACTIVIDAD ES PARA ESTUDIO INDIVIDUAL YA QUE QUEDÓ PENDIENTE DEL GRADO DÉCIMO
TERMODINÁMICA
CALOR Y TEMPERATURA
TERMODINÁMICA
CALOR Y TEMPERATURA
CALOR (Q): Es una forma de energía que se transfiere de un sistema a otro con diferente temperatura. Esta energía recibe el nombre de energía térmica.







TERMODINÁMICA
Estudia la transferencia de calor de un sistema a otro, como una manifestación de la energía que se puede transformas en otras formas de energía.
PROCESOS TERMODINÁMICOS



TEMPERATURA(T): Es la magnitud física que determina si un sistema se encuentra o no en equilibrio térmico, también se define como la medida de la energía cinética media de las moléculas que constituyen un sistema.
MEDICIÓN DE LA TEMPERATURA
El instrumento con el cual se mide la temperatura es el termómetro, cuyo funcionamiento se basa en la propiedad termométrica de la sustancia utilizada que cambie continuamente con la temperatura. En el mercado se consiguen una gran variedad de termómetros de acuerdo a la precisión o el rango de temperaturas a medir.
ESCALAS DE TEMPERATURAS
La historia nos enseña que se han diseñado diversas escalas para medir la temperatura a las cuales se les han asignado en forma arbitraria un punto inicial y un punto final.
Las escalas más comunes son: escala centígrada o Celsius, absoluta o Kelvin y la Fahrenheit.
Celsius de cero a 100, Fahrenheit de 32 a 212 y Kelvin de 273,15 a 373,15. Para la escala Kelvin se acostumbra a trabajar entre 273 y 373.

CONVERSIÓN DE TEMPERATURAS
Para realizar la conversión se utilizan los siguientes procedimientos:
- Grados Celsius a Fahrenheit: ºF = 9/5C + 32
- Grtados Fahrenheit a Celsius: ºC = 5/9(ºF - 32)
- Grados Celsius a Kelvin: ºK = ºC + 273
MEDICIÓN DEL CALOR
James Prescott Joule, demostró que cierta cantidad de trabajo mecánico producía una determinada cantidad de calor. De esta forma encontró que para elevar un grado centígrado la temperatura de un gramo de agua, se necesitaba una energía de 4,186 julios, por lo tanto
1 cal = 4,186 julios.
Las unidades de calor son el julio y la caloría.
CAPACIDAD CALÓRICA
Está definida como la cantidad de calor suministrado a una sustancia para aumentar su temperatura un grado.
CALOR ESPECÍFICO
Está definido como la cantidad de calor que se le debe suministrar a una sustancia para que su temperatura aumente un grado centígrado.
CALOR LATENTE
El calor latente puede ser de fusión (sólido a líquido) o de vaporización (líquido a vapor).
Se define como la cantidad de calor adicional que necesita una sustancia para pasar del estado sólido a líquido o de líquido a gas sin que halla un aumento en su temperatura.
También así: cantidad de calor que absorbe o cede una sustancia para cambiar de estado.
El calor latente se calcula así: Q = mL, donde L es el calor latente de la sustancia y depende del cambio de fase que en el momento presente la sustancia.


TRANSMISIÓN DEL CALOR
En las experiencias diarias notamos que el calor producido por alguna fuente calorífica se propaga por el espacio que la rodea. Esta transmisión del calor se presenta por:
- CONDUCCIÓN: se produce cuando al calentar un cuerpo un cuerpo sólido, las primeras moléculas que reciben el calor aumentan su vibración y chocan con las vecinas hasta que todas las moléculas del sólido se agitan.
CONVECCIÓN: se produce cuando el calor se transmite a través de un fluido con movimiento masivo del mismo.
- RADIACIÓN: ocurre en todos los cuerpos que radían energía en forma electromagnética como consecuencia de su temperatura. Este tipo de radiación no necesita de un medio para propagarse.
DILATACIÓN DE LOS CUERPOS
Los cuerpos se dilatan o aumentan de tamaño cuando absorben calor, este fenómeno se denomina dilatación térmica la cual ocurre en una, dos o tres dimensiones.
- DILATACIÓN LINEAL (UNA DIMENSIÓN): ocurre en los cuerpos en los que predomina la longitud como vigas, varillas, cuerdas, etc.

Ejemplo, dilatación de un puente.
Para calcular la dilatación lineal se utiliza:
- DILATACIÓN SUPERFICIAL (DOS DIMENSIONES): ocurre en los cuerpos en los que predomina el área como láminas, losas, etc.
Ejemplo, aflojar la tapa de un frasco cerrado.
Para calcular la dilatación superficial se utiliza:
- DILATACIÓN VOLUMÉTRICA (TRES DIMENSIONES): ocurre en los cuerpos donde no hay diferencias marcadas en sus dimensiones como esferas, bloques, etc.
Ejemplo, un tanque que se deja a la interperie
Para calcular la dilatación volumétrica se utiliza:
Estudia la transferencia de calor de un sistema a otro, como una manifestación de la energía que se puede transformas en otras formas de energía.
El estudio de la termodinámica se basa en el principio de la conservación de la energía a sistemas en los cuales se presentan procesos termodinámicos.
Como puede recordar, a un objeto le podemos asignar una energía cinética, potencial elástica o potencial gravitacional, sin embargo estos cuerpos están constituidos por moléculas que tienen su propio movimiento, lo cual se conoce como energía interna del cuerpo, osea la energía térmica asociada al cuerpo.
La energía térmica de los cuerpos la podemos aumentar cuando realizamos un trabajo sobre él o sometiéndolo a una fuente de calor.
De la misma forma, la energía interna de un objeto puede disminuir si cede calor o realiza un trabajo sobre otro cuerpo sistema.
Lo anterior lo podemos expresar de la siguiente forma: se produce un aumento de la energía interna de un sistema cuando se le suministra calor o disminuye cuando el sistema realiza trabajo sobre otro sistema.
El calor transferido al sistema (Q), y el trabajo realizado por el sistema (W), produce un cambio en la energía interna (U) del sistema que se representa así:
Esta expresión se conoce como la Primera ley de la Termodinámica, o sea, es el principio de conservación de la energía aplicado a un sistema cuando consideramos los procesos termodínámicos producidos en él.
PROCESOS TERMODINÁMICOS
PROCESO ADIABÁTICO: ocurre cuando un sistema está aislado y no se permite la transferencia de calor.
Por ejemplo, si tenemos un recipiente aislado del medio que contiene un gas encerrado y por medio de un émbolo aplicamos presión para variar su volumen, no se produce transferencia de calor al medio ni del medio al recipiente.
Esto implica que el trabajo realizado se transforma en variación de la energía interna del sistema.
Un ejemplo más sencillo: tenemos un recipiente con agua a temperatura ambiente, colocamos un termo dentro de ella y lo llenamos con agua caliente a la cual previamente le hemos medido la temperatura. Observamos que al cabo de un tiempo, la temperatura del recipiente no cambia ni la temperatura dentro del termo tampoco lo hace.
Decimos entonces que el sistema no gana ni pierde calor, o sea, Q = 0.
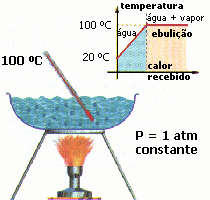
- PROCESO ISOBÁRICO: ocurre cuando un sistema presenta un proceso termodinámico a presión constante.
Por ejemplo, cuando deseamos hervir agua para el consumo. El agua está sometida a la
presión atmosférica constante para el sitio donde se hierve el agua.
También si utilizamos una olla a presión para cocinar los alimentos, el proceso se realiza a
una presión constante dentro de la olla.
- PROCESO ISOCORO O ISOMETRICO: ocurre cuando se presenta un proceso termodinámico a volumen constante.
Si tenemos, por ejemplo, una jeringa con cierta cantidad de fluido y procedemos a tapar su
extremo. Posteriormente ejercemos presión sobre el líquido y como ya saben, no se observa
cambio en el volumen del fluido.
Si después de estudiar este tema les da sed, pueden tomar un vaso, un licor muy suave y
colocarle trozos de hielo. Pueden observar que unos minutos después el volumen del líquido
no ha cambiado, permanece constante a pesar de estarse derritiendo el hielo.
En este proceso no se realiza trabajo.
- PROCESO ISOTÉRMICO: ocurre cuando se presenta un proceso termodinámico a temperatura constante.
Este proceso se presenta por ejemplo, en el funcionamiento del motor de un carro. Para que no se recaliente, el motor debe mantener una temperatura constante de trabajo y esto lo realiza el sistema de enfriamiento del motor, su papel, mantener constante la temperatura.
Pero las bebidas anteriores serían mucho mejor si la tomásemos fría. Pero hay un problema, no tenemos hielo, entonces procedemos a colocarla en la nevera. Un tiempo después nuestras bebidas están frías, el proceso se hizo a temperatura constante ya que el refrigerador lo dejamos a una sola temperatura.
Si queremos leer un libro para complementar este trabajo, utilizamos la ayuda de un bombillo el cual siempre estará a una temperatura constante irradiando energía lumínica.
En este proceso la variación de la emergía interna es cero.
Este proceso se representa así: Q = T
LEYES DE LA TERMODINÁMICA
Termodinámica es el estudio de los procesos en los que la energía se transfiere como calor y trabajo de un sistema a otro.
La termodinámica tiene dos leyes que son:
- PRIMERA LEY DE LA TERMODINÁMICA: es conocida también como el principio de conservación de la energía
 la cual establece que si se realiza trabajo sobre un sistema o bien éste intercambia calor con otro, la energía interna del sistema cambiará.
la cual establece que si se realiza trabajo sobre un sistema o bien éste intercambia calor con otro, la energía interna del sistema cambiará.
- SEGUNDA LEY DE LA TERMODINÁMICA: el calor no fluye espontáneamente de los sistemas más fríos a los sistemas más calientes; o también que cada vez que la energía pasa de una forma a otra, se produce una disminución de la cantidad de energía disponible para realizar trabajo.